Trong cuộc sống thường ngày hẳn nhiều khi bạn bắt gặp Natri cacbonat. Bạn sẽ tự hỏi Natri cacbonat là gì? Những đặc tính của nó ra sao và ứng dụng thế nào trong thực tế… Vậy hãy cùng VIETCHEM khám phá bạn nhé!
Tổng quan về Natri cacbonat
1. Natri cacbonat là gì?

Natri cacbonat hay còn được gọi là soda, là một loại muối cacbonat của natri có công thức hóa học là Na2CO3. Đây là một loại muối bền trong tự nhiên, thường có trong nước khoáng, nước biển và muối mỏ ở trong lòng đất. Một số rất ít sẽ tồn tại ở dạng tinh thể có lẫn calci cacbonat. Quá trình hình thành ở trong tự nhiên chủ yếu là do sự thay đổi địa hình Trái Đất làm một số hồ gần biển hoặc vịnh bị khép kín, dần dần lượng muối tích tụ lại và bị chôn vùi vào lòng đất sẽ tạo thành mỏ muối. Lượng muối còn lại trong tự nhiên (nước biển) được hình thành là do hòa tan khí CO2 trong không khí.
Vì có trữ lượng lớn và quá trình khai thác và điều chế khá đơn giản nên giá bán natri cacbonat trên thị trường rẻ khá rẻ: chỉ khoảng 16.000 đồng/1 kg năm 2010 (~ $0,84/1 kg). Natri cacbonat là một chất có tính ăn mòn cao, không dùng trong ăn uống và đặc biệt trong khuôn khổ gia đình hay thủ công.
2. Các tính chất vật lý và hóa học của Natri cacbonat
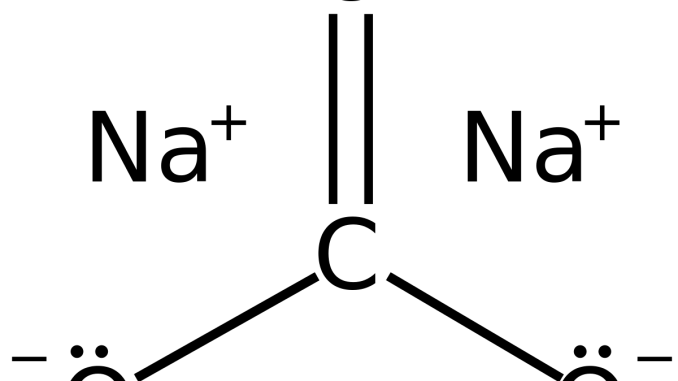
Về tính chất vật lý:
- Natri cacbonat tồn tại ở dạng chất rắn khan, không mùi, màu trắng có khả năng hút ẩm tốt
- Khối lượng riêng: 2.532 g/cm3, thể rắn.
- Khối lượng mol: 105.9884 g/mol.
- Nhiệt độ nóng chảy: 851 °C(1124 K).
- Nhiệt độ sôi: 1600 °C (2451 K).
- Nhiệt độ phân hủy t: 853o
- Độ tan: Tan hoàn toàn ở trong nước nóng, glycerol, axit sunfuric . Ở 20°C, độ tan trong nước của Natri cacbonat là 22 g/100 ml, phản ứng tỏa nhiệt lớn. Hòa tan một phần trong dung dịch acetone, alcohol và methanol.
- Trạng thái dung dịch của Natri cacbonat:
+ Kết tinh thành Na2CO3.10H2O – nếu nhiệt độ thấp hơn 32.5°C
+ Tạo thành tạo Na2CO3.7H2O nếu nhiệt độ trong khoảng 32.5 – 37.5°C
+ Biến đổi thành Na2CO3.H2O nếu nhiệt độ khoảng 37.5°C đến dưới 107°C
+ Trở thành natri cacbonat khan do nước hoàn toàn bị bốc hơi hết nếu nhiệt độ từ 107°C
- Hidrat được hình thành do hòa tan natri cacbonat trong nước có độ tan thay đổi theo nhiệt độ, bởi thế nhiệt độ càng cao thì độ tan càng lớn trong khi điều này lại ngược lại hoàn toàn với monohydrate.
- Trong không khí, chất decahydrate Na2CO3.10H2O dễ xảy ra những hiện tượng thoát nước để trở thành dạng bột có màu trắng Na2CO3.5H2
- Tính ăn mòn: hóa chất này không ăn mòn thủy tinh nhưng dung dịch natri cacbonat đặc nóng có thể ăn mòn được cả thép.
Về tính chất hóa học:
- Natri cacbonat có thể làm thay đổi màu sắc chất chỉ thị khi bị thủy phân trong nước do tạo ra dung dịch Na2CO3 có tính chất bazơ yếu:
- Dung dịch phenolphtalein từ không màu chuyển thành màu hồng.
- Quỳ tím chuyển thành màu xanh.
Các phương trình phản ứng:
Na2CO3 → 2Na+ + CO32−
CO32− + H2O ↔ HCO3− + OH−
- Natri cacbonat tác dụng với axit mạnh, sủi bọt, tạo thành muối, nước và các khí cacbonic:
Phương trình phản ứng: Na2CO3 + 2HCl → 2NaCl + H2O + CO2
- Phản ứng với muối tạo thành hai muối mới:
Phương trình phản ứng: Na2CO3 + CaCl2 → 2NaCl + CaCO3
- Tác dụng với CO2 và nước xảy sẽ ra phản ứng thuận nghịch:
Phương trình phản ứng: Na2CO3 + CO2 + H2O ↔ 2NaHCO3
- Tác dụng mạnh với F2, lithium và 2,4,6- trinitrotoluen.
- Không tương thích với một số chất như: phosphorus pentoxit, fluoride, amoniac + bạc nitrat, 2,4,6- trinitrotoluen, amoniac, axit, natri sunfat + nước, hydrogen proxit, nhôm (gây nổ nếu nhôm đang nóng đỏ), natri sunfat, zic, canxi hidroxit, natri cacbonat + amoni (sẽ tạo thành dung dịch arabic gum gây nổ).
3. Điều chế Natri cacbonat thế nào

3.1. Điều chế Natri cacbonat trong tự nhiên
Chất này tồn tại trong tro của rong biển ở một số vùng ở đại dương miền Tây Nam Tây Ban Nha (25–30% ) hoặc các hồ muối hoặc mỏ muối dưới dạng Na2CO3.nH2O và Na2CO3.NaHCO3.2H2O ở những khu vực thung lũng có mưa nhiều, nhiều không khí khô và gần núi đá vôi.
Sản xuất hóa chất này từ các loại đá quặng trong tự nhiên: Quặng natri cacbonat được tìm thấy nhiều nhất một số quốc gia như: Botswana, Trung Quốc, Ai Cập, Ấn Độ, Kenya, Mexico, Peru, Nam Phi, Thổ Nhĩ Kỳ và Mỹ. Trên thế giới có hơn 60 loại quặng natri cacbonat và chiếm khoảng 1/3 sản lượng natri cacbonat.
Tuy nhiên, chất hóa học mà chúng ta thu được lại không có độ tinh khiết cao vì có chứa nhiều tạp chất như muối clorua, sunfat và các chất không hòa tan.
Hiện nay, các hồ, mỏ muối lớn phần lớn tồn tại ở châu Phi, châu Mỹ, châu Âu, Ấn Độ như Iga Fdi, Bora, Tơ-ron, vùng Cát Biên, Segedin và Lu-na.
Để khai thác được natri cacbonat từ sâu trong lòng đất, người ta cho nước nóng xuống giếng khoan với mục đích là hoà tan natri cacbonat đến khi đạt mức nồng độ là 32 độ Bô-mê sau đó đưa lên mặt đất, tiếp đến mang đi đem hòa tan rồi kết tinh phân đoạn để thu lấy sản phẩm tinh khiết.
3.2. Điều chế Natri cacbonat trong công nghiệp
Phương pháp sunfat – Phương pháp Leblanc
Nung hỗn hợp natri sunfat cùng than và đá vôi trong điều kiện nhiệt độ là 1000oC
Phương trình phản ứng:
Na2SO4 + 2C → Na2S + 2CO2
Na2S + CaCO3 → Na2CO3 + CaS
Mang hỗn hợp sản phẩm đã được tạo ra từ phản ứng hòa tan với nước để tách CaS do nó không tan. CaS sau đó có thể tiếp tục được sử dụng để sản xuất lưu huỳnh.
Sử dụng amoniac để làm phương pháp Solvay
Phương trình phản ứng: NaCl + NH3 + CO2 + H2O ↔ NaHCO3 + NH4Cl
NaHCO3 ít tan trong nước được tách ra và nhiệt phân tạo thành Na2CO3
Phương trình phản ứng: 2NaHCO3 ↔ Na2CO3 + CO2 + H2O
Các sản phẩm phụ, sau phản ứng lại được tiếp tục chế hóa lại để sử dụng lại cho quá trình điều chế sản phẩm Na2CO3 tiếp theo.
4. Ứng dụng của Natri cacbonat
Hóa chất này có 2 dạng đó là dạng nặng và dạng nhẹ.
Dạng nặng (khối lượng riêng là 1 kg/dm3): Được dùng trong ngành công nghiệp chế tạo thủy tinh. Dạng nhẹ (khối lượng riêng là 0,5kg/dm3)
Natri cacbonat chiếm khoảng 13 – 15% trong tổng số các nguyên liệu sản xuất thủy tinh, dùng để nấu thủy tinh, làm hạ nhiệt độ nung chảy cát silic trong và làm tăng thêm tính mềm dẻo. Dù đứng ở giữ vị trí thứ 2 về khối lượng chất đưa vào nhưng chi phí của nó lại chiếm lên đến 50 – 60% tổng chi phí nguyên liệu sản xuất.
Đối với công nghiệp sản xuất
- Natri cacbonat được dùng trong công nghiệp sản xuất ra xà phòng và các loại chất tẩy rửa. Chúng là chất độn và là chất phụ gia trong xà phòng cũng như chất tẩy rửa với nhu cầu sử dụng chiếm khoảng 10 – 12% trên toàn thế giới.
- Đây là chất đầu để sản xuất nhiều hợp chất của natri rất quan trọng như xút ăn da, borac, thủy tinh tan, cromat và đicromat, nó chiếm 30% nhu cầu. Thi thoảng, Natri cacbonat lỏng cũng được sử dụng để thay thế cho Na2CO3 nhưng đa phần nó vẫn được lựa chọn vì tính sẵn có và giá thành tương đối thấp.
- Dung dịch Na2CO3 được dùng để loại bỏ lớp dầu mỡ tồn tại trên bề mặt các chi tiết máy trước khi phun sơn hoặc tráng kim loại nhờ vào tính năng mài mòn và tác dụng với một số chất (đóng cặn).
- Xử lý nước thải và khí thải bằng việc loại bỏ đi lưu huỳnh.
- Tinh chế dầu và sản xuất chất nổ, hay cao su tổng hợp.
Trong ngành y tế
- Sản xuất một số loại thuốc sủi bọt bằng phương thức tạo bọt và tăng độ pH như thuốc đau đầu và C sủi…
- Sản xuất các loại thuốc đau dạ dày.
- Làm nước súc miệng hoặc được sử dụng trực tiếp chà lên răng để loại bỏ mảng bám giúp làm trắng răng…
Trong ngành công nghiệp thực phẩm

- Nó được dùng làm chất tạo xốp, giòn (bột nở) cho nhiều loại bánh khác nhau như cookies, muffin, biscuits, quẩy do khi gặp nhiệt độ cao hay tác dụng với các chất có tính axit và baking Na2CO3 sẽ giải phóng ra khí cacbonic.
- Làm giảm độ axit, độ chua của sốt cà chua và cả nước chanh.
- Ngâm đậu trong dung dịch natri cacbonat sẽ giúp rút ngắn thời gian nấu, đậu sẽ nhanh chín nhừ, từ đó khắc phục đáng kể tình trạng đầy bụng khó tiêu khi ăn các loại hạt đậu và đỗ.
- Làm mềm đồ ăn nhanh chóng trong các món hầm do khí cacbonic thoát ra sẽ ngấm vào thực phẩm.
5. Natri cacbonat – Những điều cần lưu ý khi lưu trữ và sử dụng
Natri cacbonat có nguy hiểm hay không?
Với các loài động vật:
- Đây là chất gây độc cấp tính thông qua đường tiêu hóa LD50: 4090 mg/kg.
- Chất này gây độc cấp tính qua đường hô hấp do bụi của hóa chất LC50: 1200 mg/m3.
- Ảnh hưởng tới các chức năng sinh sản của động vật
Với con người:
- Khi tiếp xúc với da – gây kích ứng trên da, khiến da bị phỏng, có thể bị ăn mòn tùy thuộc vào nồng độ của hóa chất, vị trí tiếp xúc và khoảng thời gian phơi nhiễm.
- Khi tiếp xúc với đường hô hấp Natri cacbonat – Bụi của hóa chất gây tổn thương cho phần trên hệ hô hấp, lớp niêm mạc mũi, lớp màng nhầy gây ra các hiện tượng ho và gây nên khó thở thậm chí viêm phổi.
- Khi Na2CO3 tiếp xúc với đường tiêu hóa – làm cho hệ tiêu hóa bị tổn thương, gây kích ứng. Tùy thuộc vào nồng độ của hóa chất, nạn nhân có thể bị buồn nôn, ói, tiêu chảy, khát nước và đau vùng bụng. Natri cacbonat thẩm thấu vào máu cũng làm ảnh hưởng không tốt tới hệ tim mạch.
- Nếu tiếp xúc với mắt – gây nên tổn thương lớp niêm mạc mắt, khiến mắt bị phỏng, đỏ và bị sưng. Nếu natri cacbonat có nồng độ cao và đậm đặc có thể khiến lớp màng sừng bị mờ đục đi vĩnh viễn.
Chú ý:
Khi sử dụng hóa chất này bạn phải mang trang phục bảo hộ lao động thích hợp như găng tay, quần áo, ủng và kính mắt,…Nếu khu vực làm việc thiếu khí cần phải sử dụng mặt nạ thở có khả năng phòng độc tốt.
Gợi ý nơi mua Natri cacbonat chất lượng, giá tốt
Sau khi cùng VIETCHEM tìm hiểu về Natri cacbonat là gì, chắc các bạn đã biết được thêm rất nhiều thông tin rồi đúng không nào? Natri cacbonat hay còn gọi là soda có rất nhiều ứng dụng trong cuộc sống của chúng ta. Nếu bạn đang tìm kiếm đơn vị tin cậy để mua soda – hãy liên hệ ngay với VIETCHEM – Hotline: 0826 010 010 để các tư vấn viên có thể hỗ trợ bạn nhé!

Để lại một phản hồi